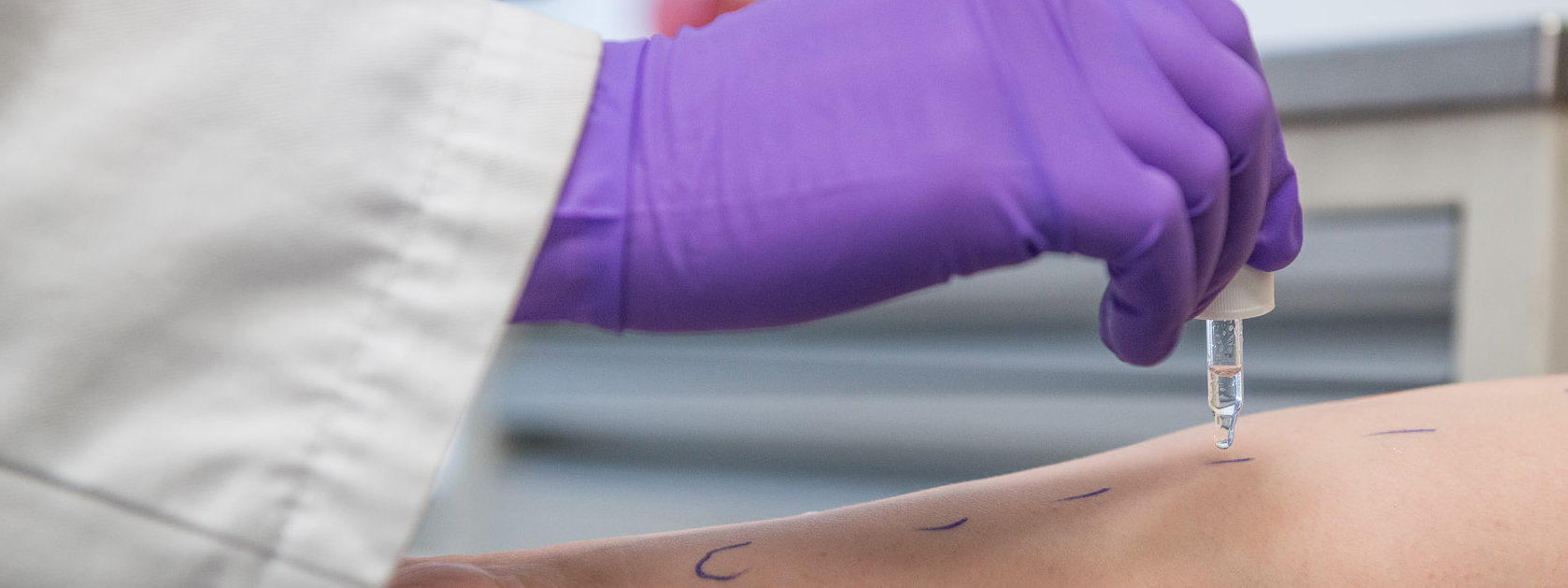
Aktuelle und geplante klinische Studien der Universitätsklinik für Dermatologie, Venerologie, Allergologie und Phlebologie und des HautTumorCentrum Minden (HTCM)
Beim Klick auf den Button öffnet sich unsere aktuelle Studiendatei:
Studien Dermatologie
Finden Sie Ihre Klinik oder Ihr Institut
Für Ihre Suche wurde leider kein Ergebnis gefunden. Bitte geben Sie mindestens drei Zeichen ein. Johannes Wesling Klinikum Minden- Allgemeinchirurgie
- Anästhesiologie, Intensiv & Notfallmedizin
- Apotheke
- Dermatologie
- Endokrinologie
- Frauenheilkunde & Geburtshilfe
- Gefäßchirurgie
- Gastroenterologie
- Geriatrie
- Hals-, Nasen-, Ohrenklinik
- Hygiene
- Kardiologie
- Kinder- & Jugendmedizin
- Labor
- Mund-, Kiefer- & Gesichtschirurgie
- Nephrologie
- Neurochirurgie
- Neurologie und Neurogeriatrie
- Notaufnahme
- Onkologie
- Pathologie
- Pneumologie
- Radiologie
- Rheumatologie
- Unfallchirurgie
- Urologie
- Allgemein- & Viszeralchirurgie
- Anästhesiologie
- Apotheke
- Frauenheilkunde & Geburtshilfe
- Gastroenterologie
- Geriatrie
- Hygiene
- Kardiologie & Pneumologie
- Labor
- Notaufnahme
- Pathologie
- Radiologie
- Unfallchirurgie & Orthopädie
- Urologie
- Allgemeinchirurgie
- Anästhesiologie
- Apotheke
- Frauenheilkunde & Geburtshilfe
- Gefäßchirurgie
- Hygiene
- Innere Medizin & Pneumologie
- Innere Medizin & Gastroenterologie
- Labor
- Schmerzmedizin
- Notaufnahme
- Pathologie
- Radiologie
- Unfallchirurgie & Handchirurgie
Finden Sie Ihre*n medizinische*n Expert*in
Notfallnummern
Bei Lebensgefahr
112
Kassenärztlicher Bereitschaftsdienst für Kinder und Erwachsene
116 117
KV-Notfallpraxen
Standorte und Öffnungszeiten
Notaufnahmen
Zu den MKK-Notaufnahmen
Vertrauliche Spurensicherung nach sexualisierter Gewalt
Kontakt und Infos
Psychiatrische Notfälle
Notaufnahme am Krankenhaus Lübbecke
Das Spendenformular wird über einer externen Seite geladen, bitte stimmen Sie das Laden der Skripte zu.
Diesesmal zustimmenDatenschutz Einstellungen